高中化学学科知识与教学能力考试试题(一)
考试总分:150分
考试类型:模拟试题
作答时间:120分钟
已答人数:137
试卷答案:有
试卷介绍: 高中化学学科知识与教学能力考试试题(一)已经整理好,需要备考的朋友们赶紧来刷题吧!
试卷预览
-
1. 活动表现评价是一种值得倡导的评价方式。活动表现评价应体现( )。①独立性②综合性
③实践性④理论性
⑤开放性A①③⑤
B②③⑤
C①④⑤
D②④⑤
-
2. 下列说法正确的是( )。
A在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀
B司母戊鼎、定远舰甲板、有机玻璃等原材料属于合金
C聚酯纤维、碳纤维、光导纤维都属于有机高分子材料
D用酸性重铬酸钾溶液检验酒驾,发生的反应属于氧化反应
-
3. 下列关于管套实验装置(部分装置未画出)进行的实验,叙述错误的是()。

A利用甲装置可以制取少量H2
B利用乙装置(P处放带火星木条,q处伸入水中)可以验证Na2O2与水反应既生成氧气,又放出热量
C利用丙装置验证KHCO3和K2CO3的热稳定性,X中应放的物质是K2CO3
D利用丁装置制取SO2,并检验其还原性,小试管中的试剂可为酸性KMnO4溶液
-
4. 以实验为基础是化学学科的重要特征之一,化学实验对全面提高学生的科学素养有着极为重要的作用。下列关于化学实验的作用说法不正确的是( )。
A化学实验能够激发学生的化学学习兴趣
B化学实验能够创设生动活泼的化学教学情境
C实验探究是转变学生学习方式和发展科学探究能力的重要途径
D化学实验是落实“情感态度与价值观”目标的唯一手段
-
5. 高中化学课程由若干课程模块构成,每个课程模块( )学分。
-
6. 基础教育课程改革的指导思想是( )。
A“三个代表”和“八荣八耻”
B“三个面向”和“八荣八耻”
C邓**理论和“三个代表”
D“三个面向”和“三个代表”
-
7. 下列关于探究学习与教学的认识正确的是( )。
A探究学习重过程,轻结论
B探究学习中仍需要教师的指导
C所有的教学内容都要使用探究教学
D只有实验教学才是探究教学
-
8. 高水平学生在测验中能得高分,而低水平学生只能得低分,说明该测验下列哪种质量指标高?( )
A效度
B信度
C区分度
D难度
-
9. 下列说法中,不正确的是( )。
A21世纪,化学科学还将继续推动材料科学的发展使各种新型功能材料的生产成为可能
B化学家可以在微观层面上操纵分子和原子,组装分子材料、分子器件和分子机器
C现代量子化学理论的建立是进入20世纪后现代化学的重大成就
D化学研究会造成严重的环境污染,最终人类将毁灭在化学物质中
-
10.
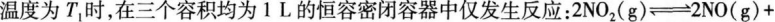
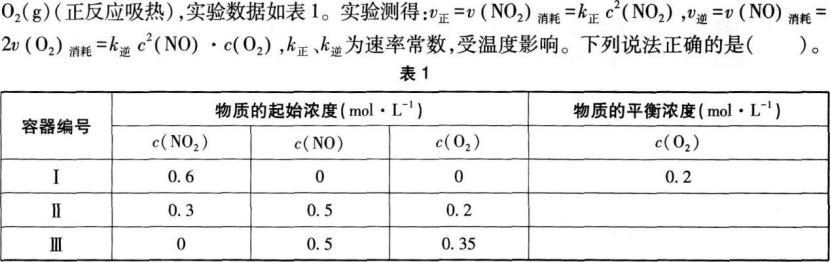
A达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为4:5
B
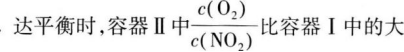
C达平衡时,容器Ⅲ中NO的体积分数大于50%
D当温度改变为T2时,若K正=K逆,则T2>T1
-
11. 新课程倡导的发展性评价的基本内涵包括( )。①评价的目的在于促进发展
②体现最新的教育观念和课程评价发展的趋势
③评价内容综合化、方式多样化、主体多元化
④关注发展过程,将形成性评价与终结性评价有机结合起来A①②④
B②③④
C①②③
D①②③④
-
12. 2011年为国际化学年,它的主题是“化学,我们的生活,我们的未来”,旨在纪念化学学科取得的成就及对人类的巨大贡献。下列叙述不能直接体现这一主题的是( )。
A风力发电.让能源更清洁
B合成光纤,让通讯更快捷
C合成药物,让人类更健康
D环保涂料,让环境更宜居
-
13. 下列叙述中,正确的是( )。
①电解池是将化学能转变成电能的装置
②原电池是将电能转变成化学能的装置
③金属和石墨导电均为物理变化,电解质溶液导电是化学变化
④不能自发进行的氧化还原反应,通过电解的原理有可能实现
⑤电镀过程相当于金属的“迁移”,可视为物理变化A①②③④
B③④
C③④⑤
D④
-
14. 科学家对石墨进行处理使得石墨片的厚度逐渐变薄,最终获得目前已知的最薄的材料——石墨烯。石墨烯作为电导体,它和铜有着一样出色的导电性;作为热导体,它比目前任何其他材料的导热效果都好。下列关于石墨烯的说法正确的是( )。
A石墨烯与C60互为同素异形体
B石墨烯与有机物烯烃一样,是一种有机化合物
C石墨烯是一种新型的纳米化合物
D石墨制取石墨烯的过程是化合反应
-
15. 现有失去标签的氯化钙、硝酸银、盐酸、碳酸钠4种无色溶液。将它们编号为甲、乙、丙、丁后,两两混合的现象如表1所示。根据实验现象判断甲溶液中溶质的化学式是( )。

ACaCl2
BAgNO3
CHCl
DNa2CO3
-
16. 焰色反应是某些金属或它们的化合物在无色火焰中灼烧时使火焰呈现特征颜色的反应,下列元素与其对应的焰色反应特征颜色错误的是( )。
ANa——黄色
BCu——绿色
CK——蓝色
DCa——砖红色
-
17. 碱性硼化钒(VB2)一空气电池工作时发生的反应为:
 用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图4所示。下列说法正确的是( )。
用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图4所示。下列说法正确的是( )。 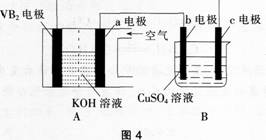
A电池工作时,VB2电极发生的电极反应为:

B电池工作时,0H-向a电极移动
C实验过程中,电极b上发生的电极反应为:

D实验过程中,电子从b电极流向a电极
-
18. 下列实验现象描述的不合理的是( )。
A把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B用锌片作阳极,铁片作阴极,电解氯化锌溶液,铁片表面出现一层锌
C把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
-
19. 某无色溶液中加入铝粉会产生氢气,则下列离子组一定可以在该溶液中大量共存的是( )。
A
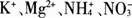
B
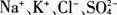
C
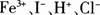
D
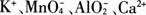
-
20. 下列说法正确的是( )。
A增加体系压强,活化分子百分数增加,化学反应速率一定增大
B升高温度,活化分子百分数增加,化学反应速率一定增大
C活化分子间所发生的碰撞均为有效碰撞
D加入反应物,活化分子百分数大大增加,化学反应速率增大
-
1. 概念原理教学提倡学生通过活动主动建构、形成并应用概念,在教学中体现概念原理知识的认识功能和价值,使学生了解知识的来龙去脉,不仅知其然,还要知其所以然。
请以“盐类水解”为例,简述概念原理要达到上述预期效果,在课堂教学中应采取哪些方法策略。
-
2. 阅读下面文字,回答有关问题。
《普通高中化学课程标准(2017年版)》的“学业要求”有这样一条要求:增进对化学的兴趣,促进树立学习和研究化学的志向,为大学学习化学相关专业提供知识、技能和能力方面的准备。
问题:
(1)中学化学教学中增强学生学习化学兴趣有何作用?
(2)在中学化学教学中,如何培养学生学习化学的兴趣?
-
1. 某化学教师在一次化学测验中设计了下面试题,并对学生的解题结果进行了统计和分析。
试题:用酸性氢氧燃料电池为电源进行电解的实验装置如图5所示,下列说法正确的是( )。 A.
A.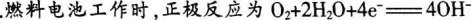
B.电解精炼铜时,若转移1mol电子,a极质量减少32g
C.铁表面镀铜时,a为铁,b为铜
D.若a,b两极为石墨,相同条件下,a极产生气体与电池中消耗的氧气体积相同
【考试结果】对参加考试的全体学生的答题情况统计如表1所示: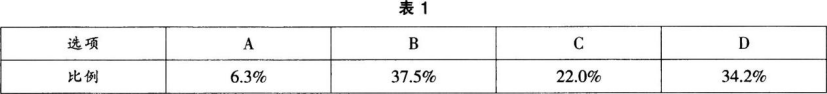
试根据上述信息,回答下列问题:
(1)本题的正确选项是什么?
(2)请分析其余三个选项,并诊断学生解答错误的原因。
(3)如果要你讲评本题,你教给学生的正确解题方法是什么?
-
1. 根据下列材料,按要求完成任务。
材料一《普通高中化学课程标准(实验)》关于离子反应的内容标准是:通过实验事实认识离子反应及其发生的条件,了解常见离子的检验方法。
材料二某版高中教科书化学l中“离子反应”的部分内容
由于电解质溶于水后成为离子,所以,电解质在溶液中的反应必然有离子参加,这样的反应称作离子反应。
【实验2-1】
材料三教学对象为高中一年级学生,本节内容是初中学习溶液导电性实验、酸碱盐电离知识的延续和深化,又是学习电解质溶液理论知识的基础,起承上启下的作用。
要求:
(1)材料二中“实验1”和“实验2”的现象分别是什么?
(2)完成“离子反应”的教学设计,内容包括教学目标,教学重点、难点,教学过程。
-
1. 根据下列材料,按要求完成任务。材料一《普通高中课程标准(实验)》的内容标准:根据生产、生活中的应用实例或通过实验探究,了解钠、铝、铁、铜等金属及其重要化合物的主要性质,能列举合金材料的重要应用。
材料二“铁的重要化合物”内容属于高中化学必修阶段的无机元素化合物的教学内容,必修化学课程中的无机元素化合物知识安排在《化学l》的“主题3常见无机物及其应用”中。普通高中课程标准使用教科书《化学1》的目录:
第一章从实验学化学
第二章化学物质及其变化
第三章金属及其化合物
第一节金属的化学性质
第二节几种重要的金属化合物
第三节用途广泛的金属材料
第四章非金属及其化合物
材料三以下是某教师设计的教学活动:
【学生活动】阅读教材关于铁的氧化物的介绍,利用分类法归纳FeO、Fe2O3、Fe3O4的性质,并填写表格。
【学生实验1】氢氧化铁、氢氧化亚铁的制备与Fe3+离子检验(整合实验)。
【问题情景1】阅读课文,结合实验现象,思考与讨论:
1.利用KSCN溶液,可以根据什么现象检验溶液中Fe3+的存在?Fe2+离子遇到KSCN会产生相同的现象吗?
2.FeSO4溶液滴加KSCN溶液一段时间后,再次观察溶液的颜色,出现了什么变化?该变化说明了什么?由此你可以得出什么结论?
3.Fe(OH)2沉淀是什么颜色?为什么往FeSO4溶液中滴加NaOH溶液后生成的沉淀会出现颜色变化?
【师生小结】略
【问题情景2】
1.从Fe2+被O2氧化为Fe3+,体现了Fe2+的什么性质?除了O2,还有哪些物质可以氧化Fe2+?
2.若要实现从Fe3+转为Fe2+的变化,需要加入什么物质?
【学生实验2】Fe2+与Fe3+的转化,按照教材第61页科学探究进行实验,观察与记录实验现象。
【问题情景3】结合实验探究的现象,思考与讨论:
1.Fe3+与铁粉充分反应后的产物是什么?如何证明?
2.回忆前面有关Fe2+的实验,为什么用Fe与稀硫酸制备FeSO4溶液,并保持铁过量?
3.实验中如何判断Fe3+已充分反应?反应不充分对实验结果有何影响?
【师生小结】略
【问题情景3】学生课后思考与讨论
通过学习我们知道,Fe2+离子和Fe(OH)2中+2价的铁均易被氧化。根据所学的知识,思考:利用FeSO4溶液和NaOH溶液时,如何通过实验条件的控制,制备较纯净的Fe(OH)2白色沉淀?
请根据上述材料,完成“铁的化合物”这一教学片段的有关任务:
(1)试确定本课的三维教学目标。
(2)说明本节课的教学策略。
(3)请对本课内容进行板书设计。
(4)请对本课内容设计导入。
-
高中信息技术学科知识与教学能力模拟题(三)138人做过
-
2021上半年教师资格证考试《高中体育》真题及答案164人做过
-
高中信息技术学科知识与教学能力模拟题(二)435人做过
-
2017下半年教师资格证考试《高中信息技术》真题及答案116人做过
-
高中信息技术学科知识与教学能力模拟题(一)301人做过
-
2017上半年教师资格证考试《高中信息技术》真题及答案(不完整版)419人做过
-
高中信息技术学科知识与教学能力试卷(五)222人做过
-
2018下半年教师资格证考试《高中信息技术》真题及答案(不完整版)151人做过
-
高中信息技术学科知识与教学能力试卷(四)198人做过
-
2018上半年教师资格证考试《高中信息技术》真题及答案155人做过